
苏州纳米所在基于适配体识别和纳米界面的循环肿瘤细胞高效捕获和分离方面取得进展
近年来,全球癌症发病形势愈发严峻,发病率与死亡率呈持续上升趋势。癌症转移是临床上导致癌症治疗失败和癌症患者死亡的最大原因,因此癌症转移的早期诊断与治疗可以大幅度的提高病人的治愈率,是决定很多患者生存率的一个关键因素。癌症病人血液中循环肿瘤细胞(CTC)的分离技术的发展有望实现对肿瘤病人的早期精确的无侵入式诊断,并在预后判断、疗效评价和个体化治疗方面发挥重要的指导作用。尤其如能实现CTC的高纯度、高活性分离,则可进一步实现对CTC的分子鉴定和功能分析,进而可研究癌症转移的机理。然而,现有技术在捕获的效率、活性及纯度方面还面临挑战。近来,中国科学院苏州纳米技术与纳米仿生研究所纳米生物医学部裴仁军团队在基于适配体识别和纳米界面的CTC高效捕获和分离方面取得进展。
近年来,人们开始将纳米结构及材料用于循环肿瘤细胞分离的基础探索研究中,研究证实,细胞表面纳米尺度的结构形貌能够影响细胞的行为,如细胞吸附、细胞定向及细胞的运动性。课题组基于微纳米结构对细胞粘附行为的调控作用,制备了多尺度二氧化钛纳米柱阵列基底。该基底由直径为200 nm左右的二氧化钛纳米柱阵列构成,纳米柱本身由30-50 nm的颗粒构成,可以在不同尺度加强基底与癌细胞的相互作用,进而提高对CTC的捕获效率。在血液样本的实验中,该纳米基底对靶细胞的捕获效率高达85%-95% (ACS Appl. Mater. Interfaces, 2016, 8, 12638?12643)。
利用纳米结构的高比表面积优势及其与细胞的结构匹配作用可以极大地提高CTC的捕获效率,但同时对血液中大量血细胞的非特异吸附也随之增强,导致CTC的捕获纯度降低。为了解决这一问题,课题组借助简单快捷的电纺技术构建生物相容性良好的壳聚糖纳米粒子及纳米纤维等表面,并在表面引入一层抗粘附分子(PEG、CBMA等),利用抗粘附分子和适配体亲和分子的协同作用进行界面设计以实现CTC高效地特异性捕获,同时保障靶细胞的捕获纯度。进一步地,受启发于自然界“优胜劣汰”的法则,我们在高效捕获的基础上,基于CTC与血液细胞增殖属性差异,将已捕获细胞进行原位培养进一步提高了CTC的纯度,见图1 (Small, 2015, 11, 5444-5451)。
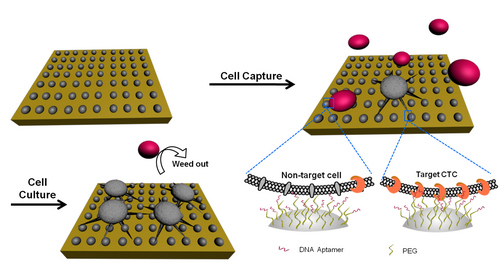
图1 基于壳聚糖纳米粒子的CTC捕获及原位培养
为了更好地满足后续的CTC的分子鉴定和功能分析的需要,保持所捕获的细胞的高活性状态并获取游离态的CTC样本十分必要。为了这一目的,课题组利用适配体替代普遍使用的抗体进行CTC的特异识别捕获,并借助抗粘附分子pCBMA的作用降低血细胞的非特异黏附。而后通过引入适配体的互补短链,因互补短链与适配体杂交可打破适配体对CTC的识别,从而可无损地释放纳米基底上捕获的CTC,见图2(Small, 2016, DOI: 10.1002/smll.201600475)。
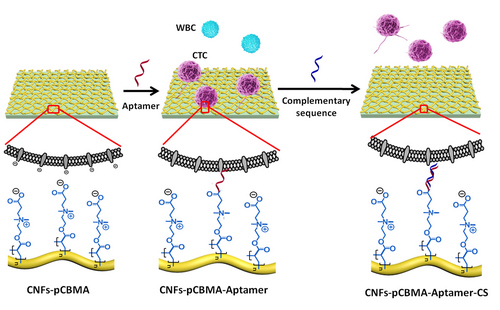
图2 基于适配体的壳聚糖纳米纤维基底的CTC高效捕获与无损释放
上述工作获得了国家自然科学基金、中科院/国家外国专家局创新国际团队、江苏省自然科学基金、江苏省“六大人才高峰”项目、苏州市科技计划、中科院苏州纳米所的大力支持。
附件下载:

