
苏州纳米所张智军团队CEJ:生物3D打印导电神经支架显著改善脊髓损伤修复效果
脊髓损伤(SCI)是一种严重的中枢神经系统创伤性疾病,全球每年有多达50万人因病致残。损伤后大脑和周围器官之间的神经连接中断,导致损伤节段以下的感觉和运动功能丧失,严重影响患者的生活质量,并且对家庭和社会带来巨大的经济负担。目前,SCI的临床治疗方式主要包括手术治疗、药物治疗和康复治疗等,尽管治疗技术有了长足的进步,但恢复患者的感觉和运动功能仍然是一个巨大挑战。
组织工程技术的迅速发展为SCI修复提供了新的策略。目前,具有特定物理和生物功能的神经支架被广泛开发,在植入后支架能够为受损脊髓组织提供力学支撑,引导神经细胞生长,改善损伤处微环境,并促进SCI的修复。为达到理想的治疗效果,组织工程支架应仿生天然脊髓的组织结构和生理功能,并针对SCI的病理生理特征对细胞和生物材料的沉积进行精确调控。由于中枢神经系统的复杂性,传统组织工程方法难以模拟脊髓组织生理结构,从而限制了治疗效果。
运用生物3D打印技术精确控制材料与细胞的分布,构建具有类脊髓组织结构和生理功能的仿生支架,植入损伤部位,是解决这一问题的有效途径。生物3D打印是将生物材料和细胞、细胞因子等按组织功能、细胞特定微环境等要求,用3D打印制造出具有个性化的体外三维模型的一种技术。近年来,中科院苏州纳米所张智军研究员团队采用挤出式生物3D打印制备了负载神经干细胞(NSC)的支架。结果表明,在支架的保护下,植入的NSC在体内存活时间长达12周,并且分化成神经元,形成神经纤维,实现轴突再生,显著改善了SCI大鼠后肢运动功能(Biomaterials 2021, 272, 120771;Acta Biomaterialia 2022, 10.1016/j.actbio.2022.08.031)。然而,目前开发的仿生支架仍然以模拟脊髓神经束的平行排列结构为主,缺乏对于脊髓组织的电生理功能的仿生,难以满足脊髓神经电信号传导的要求。
针对上述挑战,该团队开发了基于甲基丙烯酰化明胶(GelMA)、甲基丙烯酰化透明质酸(HAMA)和聚(3,4-乙烯二氧噻吩):磺化木质素(PEDOT:LS)的新型导电水凝胶(图1)。其中,GelMA/HAMA模拟神经系统细胞外基质,为支架提供力学支撑,也为NSC提供适合的生长环境;PEDOT是一类导电性高、生物相容性好的导电高分子,LS的掺杂有效提高了PEDOT的分散性。PEDOT:LS的引入显著提高支架的导电性,使得支架的电导率与天然脊髓白质相当(0.60S m-1)。通过精确调节光固化时间,水凝胶显示出与脊髓组织相似的机械性能(储能模量≈ 1 KPa),并且其多孔结构与溶胀特性适合于NSC的生长(图2)。将导电水凝胶前驱体溶液与NSC共混制备生物墨水,通过挤出式生物3D打印技术制备导电脊髓仿生支架。打印后,NSC的存活率超过90%,并且能够在支架内展现良好的增殖行为。更重要的是,与非导电支架相比,导电支架显著促进了NSC向神经元的分化(图3)。在此基础上构建大鼠脊髓全横断模型,植入仿生支架极大地促进了SCI大鼠后肢运动功能的恢复。损伤断面处免疫荧光染色结果进一步表明,导电仿生支架有效地促进了损伤部位神经元的再生,减少了胶质瘢痕的沉积,并促进了神经轴突的再生和髓鞘化(图4)。本项研究开发的导电脊髓仿生支架,为SCI的修复提供了一种新策略。
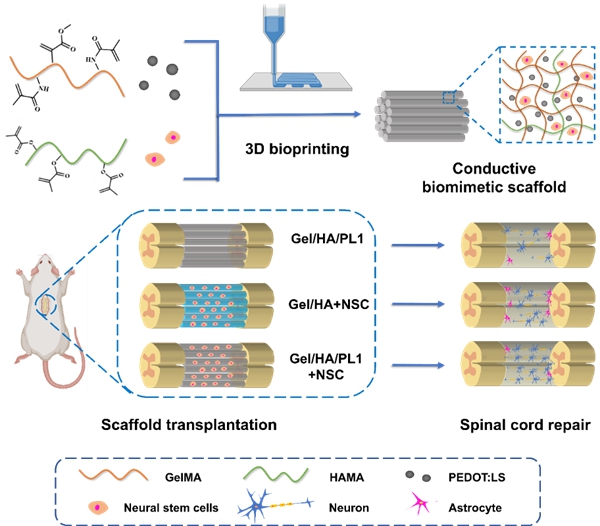 图1. 生物3D打印导电脊髓仿生支架促进脊髓损伤修复的示意图
图1. 生物3D打印导电脊髓仿生支架促进脊髓损伤修复的示意图
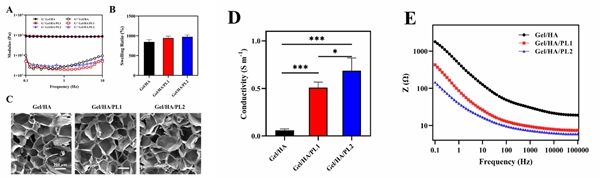 图2. 导电水凝胶的性能表征:(A)储能模量与损耗模量;(B)溶胀率;(C)SEM照片;(D)电导率;(E)阻抗谱
图2. 导电水凝胶的性能表征:(A)储能模量与损耗模量;(B)溶胀率;(C)SEM照片;(D)电导率;(E)阻抗谱
 图3. 导电水凝胶支架促进NSC向神经元分化:(A)NSC向神经元和星形胶质细胞分化的免疫荧光染色;(B)NSC分化的定量统计结果
图3. 导电水凝胶支架促进NSC向神经元分化:(A)NSC向神经元和星形胶质细胞分化的免疫荧光染色;(B)NSC分化的定量统计结果
 图4. 导电仿生支架促进脊髓损伤部位神经元再生:损伤截面处GFAP、 Tuj-1、MAP2和NF免疫荧光染色和表达量统计
图4. 导电仿生支架促进脊髓损伤部位神经元再生:损伤截面处GFAP、 Tuj-1、MAP2和NF免疫荧光染色和表达量统计
该工作以3D bioprinted conductive spinal cord biomimetic scaffolds for promoting neuronal differentiation of neural stem cells and repairing of spinal cord injury为题发表在Chemcial Engineering Journal上。中科院苏州纳米所张智军研究员和黄洁副研究员为论文的共同通讯作者,中科院苏州纳米所博士后杲辰为第一作者。该研究得到了中科院战略性先导专项(XDA16020100)、国家自然科学基金(32171367)等项目的支持。
附件下载:

