
苏州纳米所裴仁军研究团队在肿瘤液体活检方面取得进展
癌症已经成为人类生命健康的最大威胁之一,其死亡率和发病率仍在继续升高。液体活检作为一种新兴的肿瘤诊断技术,因其无创性、敏感性、操作便捷等优势受到人们的广泛关注。液体活检使用的生物标记物主要有循环肿瘤细胞(CTCs)、细胞外囊泡(EVs)和循环肿瘤DNA三种。循环肿瘤细胞是一类从肿瘤部位脱落进入外周血液循环系统的癌细胞。大量研究表明其与癌症病人的肿瘤转移、癌症复发、治疗效果评估、用药指导及预后等密切相关。然而,CTCs在癌症病人血液中的数量十分稀少,多数情况下在1 mL血液中仅有几个;此外,目前主流循环肿瘤细胞分离方法都是基于一种肿瘤标志物,例如上皮细胞粘附分子(EpCAM)、人表皮生长因子受体2(HER2)、叶酸受体等,但由于肿瘤异质性的存在会导致基于单一肿瘤标志物的捕获方法效率不理想。
针对上述挑战,中科院苏州纳米所裴仁军研究团队利用单宁酸(TA)功能化磁性纳米颗粒(MNPs),建立了一种从患者血液样本中有效分离异质性CTCs的简单、广谱的方法。研究人员利用单宁酸与铁离子的配位作用成功制备了功能化四氧化三铁磁性纳米颗粒,该材料成功从8种癌症病人的血液样品检测到CTCs。与免疫磁珠及微流控芯片技术相比,其操作过程简便,仅需要一种化学分子的修饰即可实现对多亚型癌细胞的有效捕获(图1)。相关研究成果以“Tannic Acid (TA)-functionalized Magnetic Nanoparticles for EpCAM Independent Circulating Tumor Cell (CTC) Isolation from Patients with Different Cancers”为题发表在ACS Appl. Mater. Interfaces 2021, 13, 3694-3700上。中科院苏州纳米所博士研究生丁丕为上述研究论文的第一作者。
 图1 (a)单宁酸功能化磁性纳米颗粒从血液中分离循环肿瘤细胞的原理图,(b)单宁酸分子结构。
图1 (a)单宁酸功能化磁性纳米颗粒从血液中分离循环肿瘤细胞的原理图,(b)单宁酸分子结构。
EVs是由细胞产生的纳米级囊泡,其中包含DNA、蛋白质、信使RNA、非编码RNA等成分,研究表明EVs与肿瘤的发生、发展、转移以及抗药性相关,通过对其内部信息的分析可用于癌症的早期诊断、复发监测、抗药性检测等。目前EVs分离的方法,主要包括超高速离心法、免疫磁珠法以及柱层析法。利用这些方法分离得到的样本普遍存在着较多的非肿瘤来源的EVs,从而对肿瘤的检测信号造成干扰。此外,肝细胞癌来源的EVs还存在着高度异质性,这些因素导致肝细胞癌来源EVs的特异分离更加困难。为了解决上述问题,加州大学研究团队与裴仁军研究团队合作,利用肝细胞癌特异的三种抗体,与纳米结构基底的微流控芯片进行“点击化学”反应,对病人血浆中的肿瘤来源EVs进行捕获,实现肝细胞癌来源EVs的高效高纯度分离。研究人员将三种反式环辛烯(TCO)修饰的抗体与人工样本进行孵育,对癌细胞EVs进行特异识别和标记,而后将标记后EVs的样本通入四嗪(Tz)修饰的纳米基底芯片内,通过TZ-TCO之间高效的“点击化学”反应将抗体与抗原的免疫结合转换成稳定的共价键结合,从而实现EVs的精准捕获。然后利用微滴式数字PCR(ddPCR)技术对选定的10基因组合对临床血浆样本的诊断进行验证。该研究提供了一种HCC EVs纯化系统,并对HCC特异性的mRNA转录进行数字评分,能够准确区分HCC患者与无癌症和其它恶性肿瘤患者。相关研究成果以“Purification of HCC-specific Extracellular Vesicles on Nanosubstrates for Early HCC Detection by Digital Scoring”为题发表在Nat. Commun. 2020, 11, 4489上。中科院苏州纳米所孙娜博士为上述研究论文的第一作者。
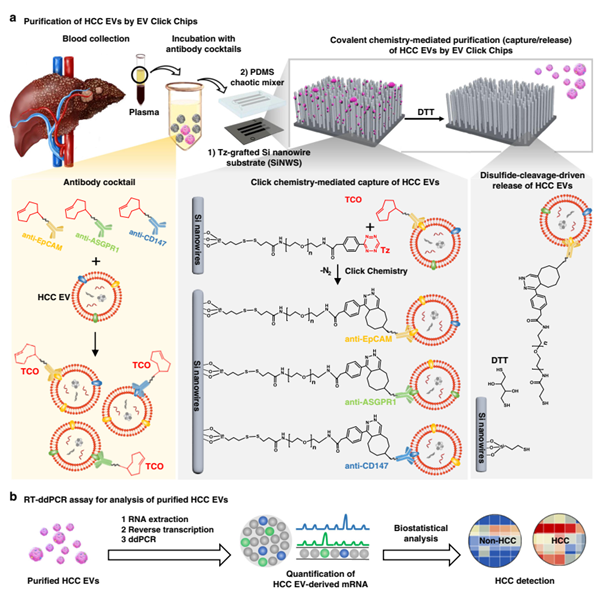 图2 肝细胞癌细胞外囊泡的纯化与分析。(a)EVs点击芯片的装置结构及工作原理,(b)将纯化的肝细胞癌EVs进行反转录微滴数字PCR(RT-ddPCR),以获得10个肝细胞癌特异性基因的检测,这些基因可用于区分出肝细胞癌患者。
图2 肝细胞癌细胞外囊泡的纯化与分析。(a)EVs点击芯片的装置结构及工作原理,(b)将纯化的肝细胞癌EVs进行反转录微滴数字PCR(RT-ddPCR),以获得10个肝细胞癌特异性基因的检测,这些基因可用于区分出肝细胞癌患者。
上述研究工作得到中国科学院对外合作重点项目(121E32KYSB20170025)的支持。
附件下载:

