
苏州纳米所类器官创新中心在核酸药物制备类器官种子细胞方面取得新进展
诱导多能干细胞(iPSCs)的定向分化为类器官构建上提供了目标特异性的种子细胞。然而,传统的多步骤分化方式效率低下,且常无法生成高功能强度的细胞。提升iPSC的定向分化效率和分化细胞的功能强度是亟待解决的重点问题。
中国科学院苏州纳米技术与纳米仿生研究所类器官中心的研究团队研究开发了一种高效的脂质纳米颗粒(LNP)递送系统。成功利用LNP递送编码多种转录因子的环状RNA(circRNA),实现对iPSCs的正向编程,将其高效分化为功能性的内皮细胞和肝样细胞,为类器官构建提供了可靠的种子细胞来源(图1)。
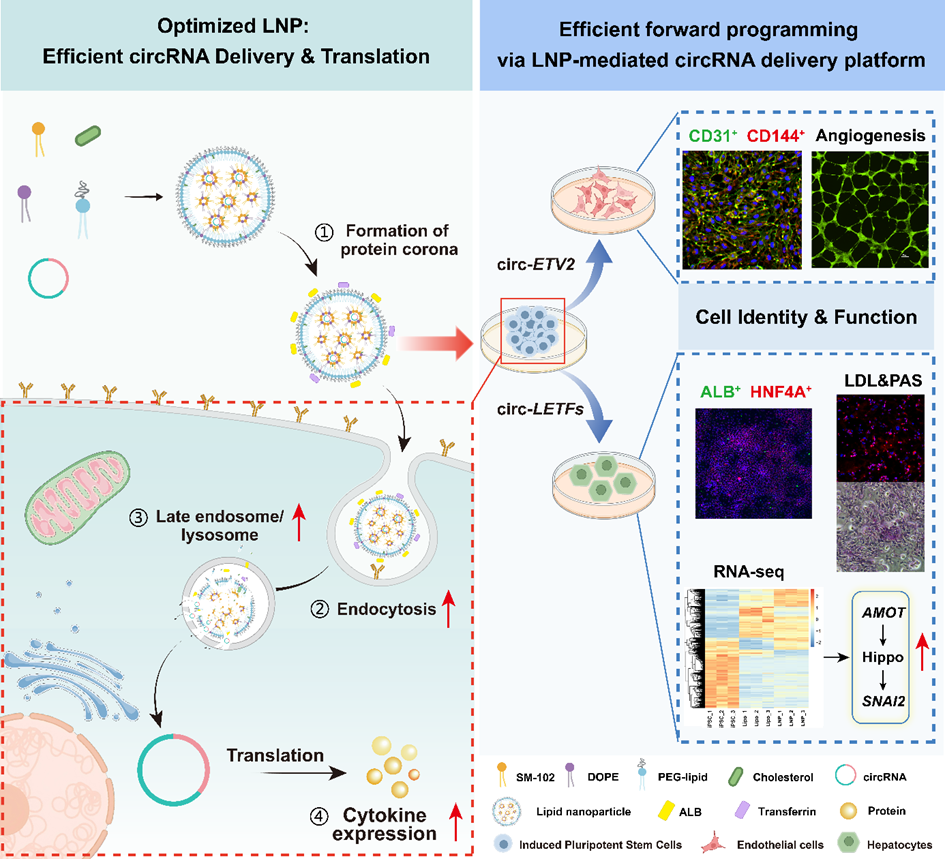
图1 LNP递送circRNA正向编程iPSC的策略
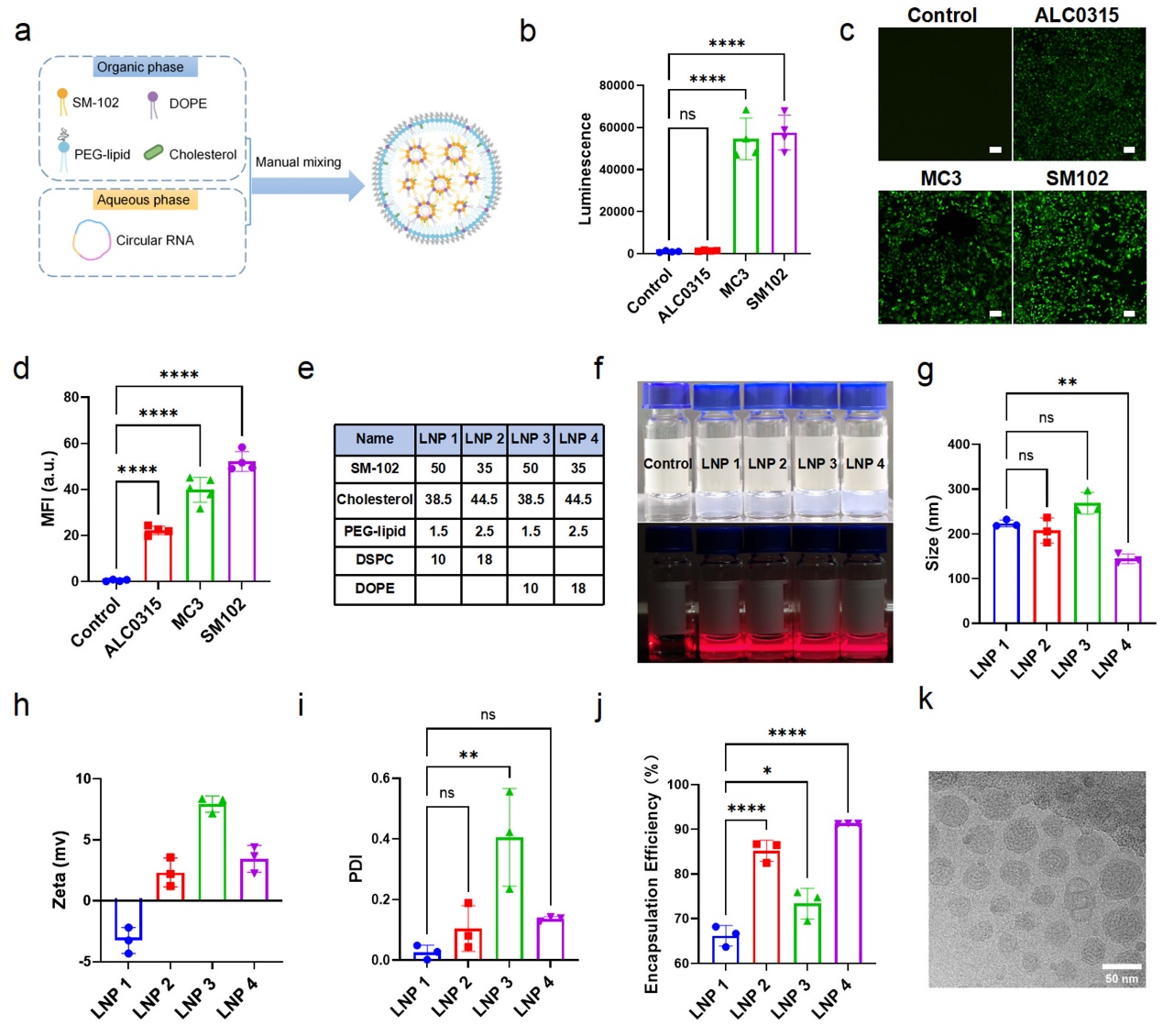
图2 LNP配方的筛选和优化
实现高效的细胞正向编程需要高效目标基因的持续稳定表达。研究团队通过系统筛选和优化,开发了基于SM-102和DOPE的LNP4配方(图2)。该配方显著提升了circRNA的细胞内递送效率和内体逃逸能力,在多种来源的iPSCs中均实现高于97%的转染效率,且细胞活性不受影响。circRNA在细胞内持续表达至96小时,远超线性mRNA(图3)。研究团队同时揭示了LNP4通过形成高白蛋白和转铁蛋白含量的蛋白冠,促进细胞摄取,并通过DOPE介导的膜融合实现高效的内质网逃逸,促进细胞内运输。
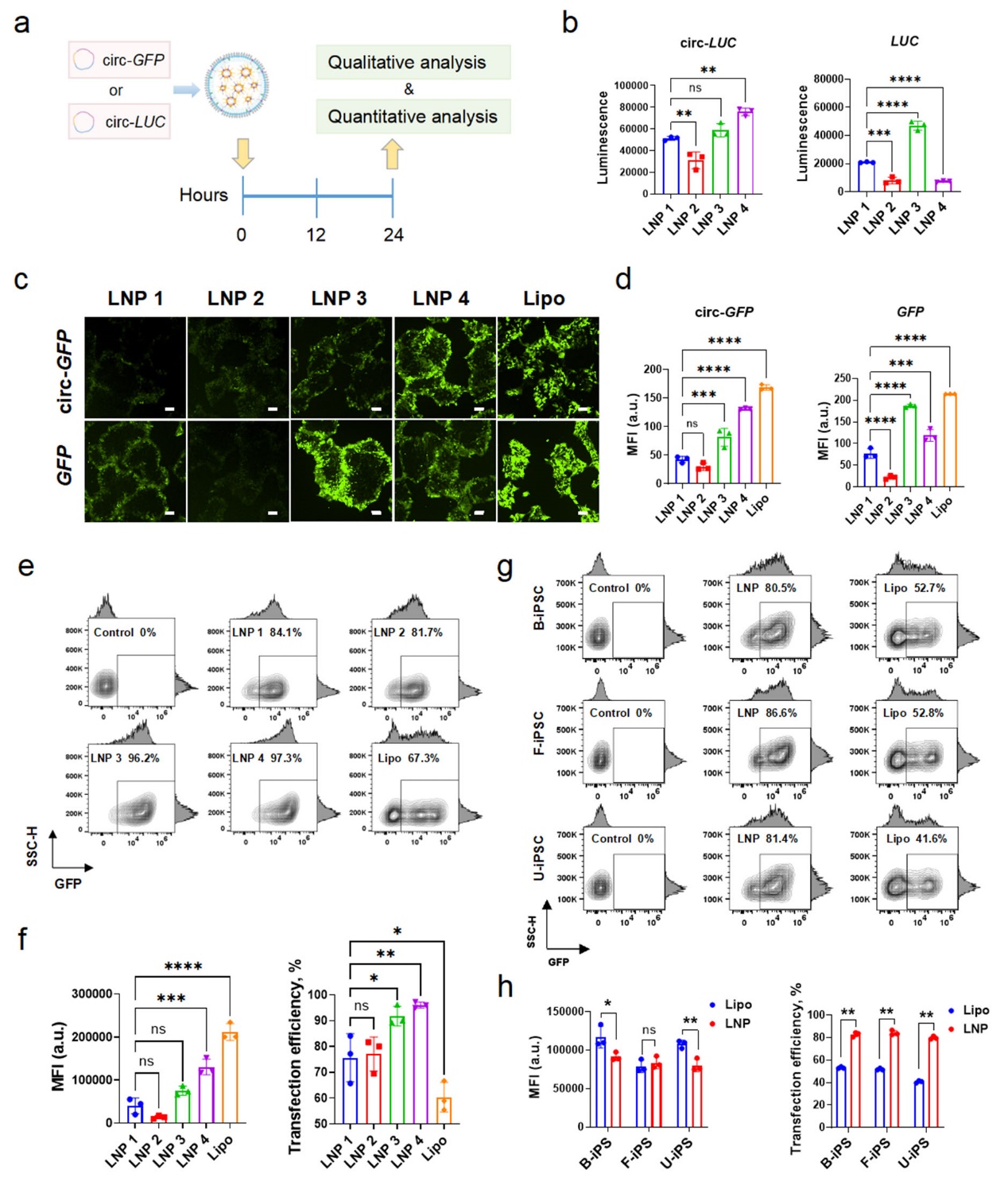
图3 LNP4展现了高circRNA递送效率及在iPSC上的高效报告基因表达
在获得LNP4配方的基础上,研究团队利用LNP4递送编码关键转录因子的circRNA,成功实现内皮细胞的正向编程。通过递送circ-ETV2,在7天内获得80.3%的CD31+/CD144+双阳性内皮细胞,且具备成管功能(图4)。
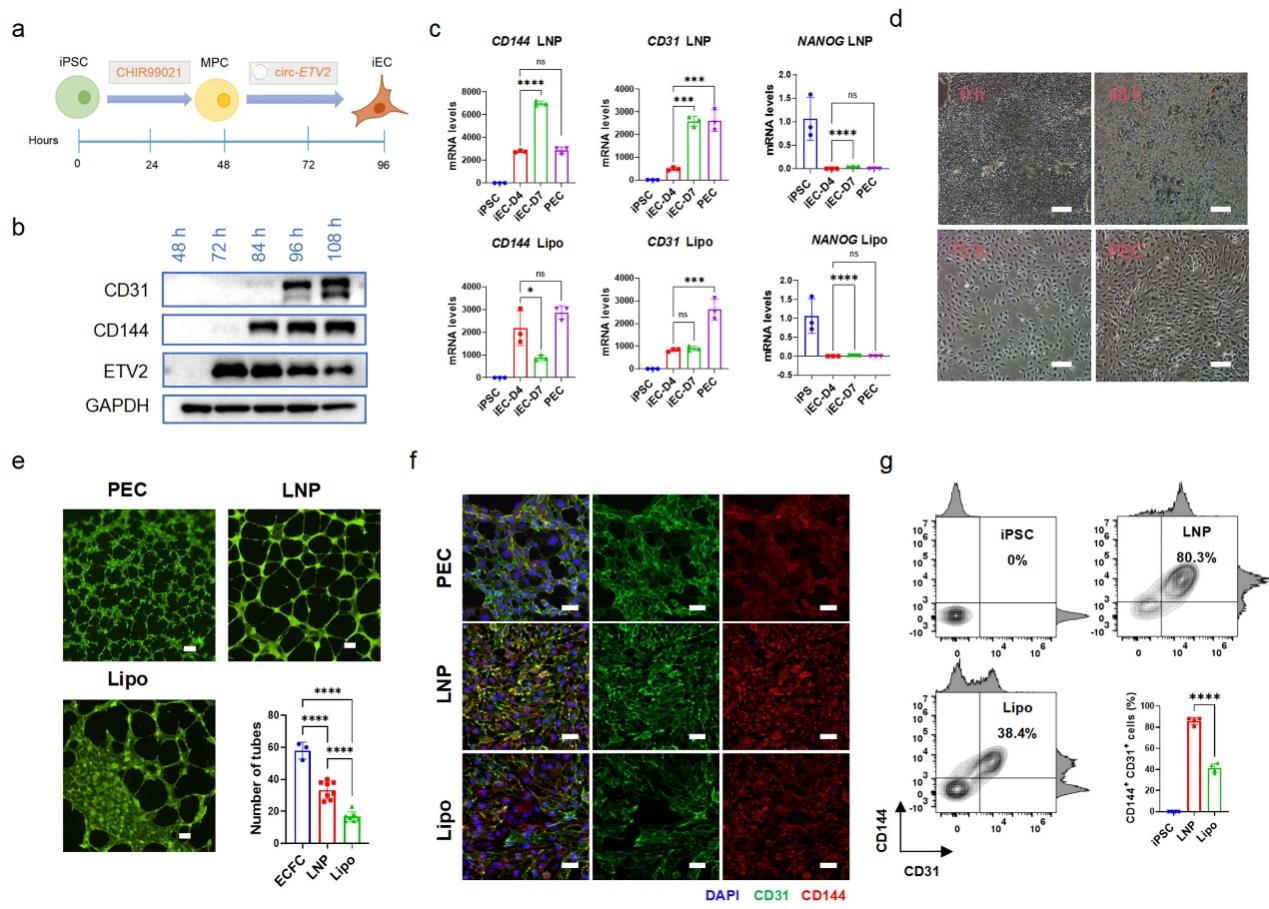
图4 circ-ETV2介导的iPSCs向内皮细胞的正向编程
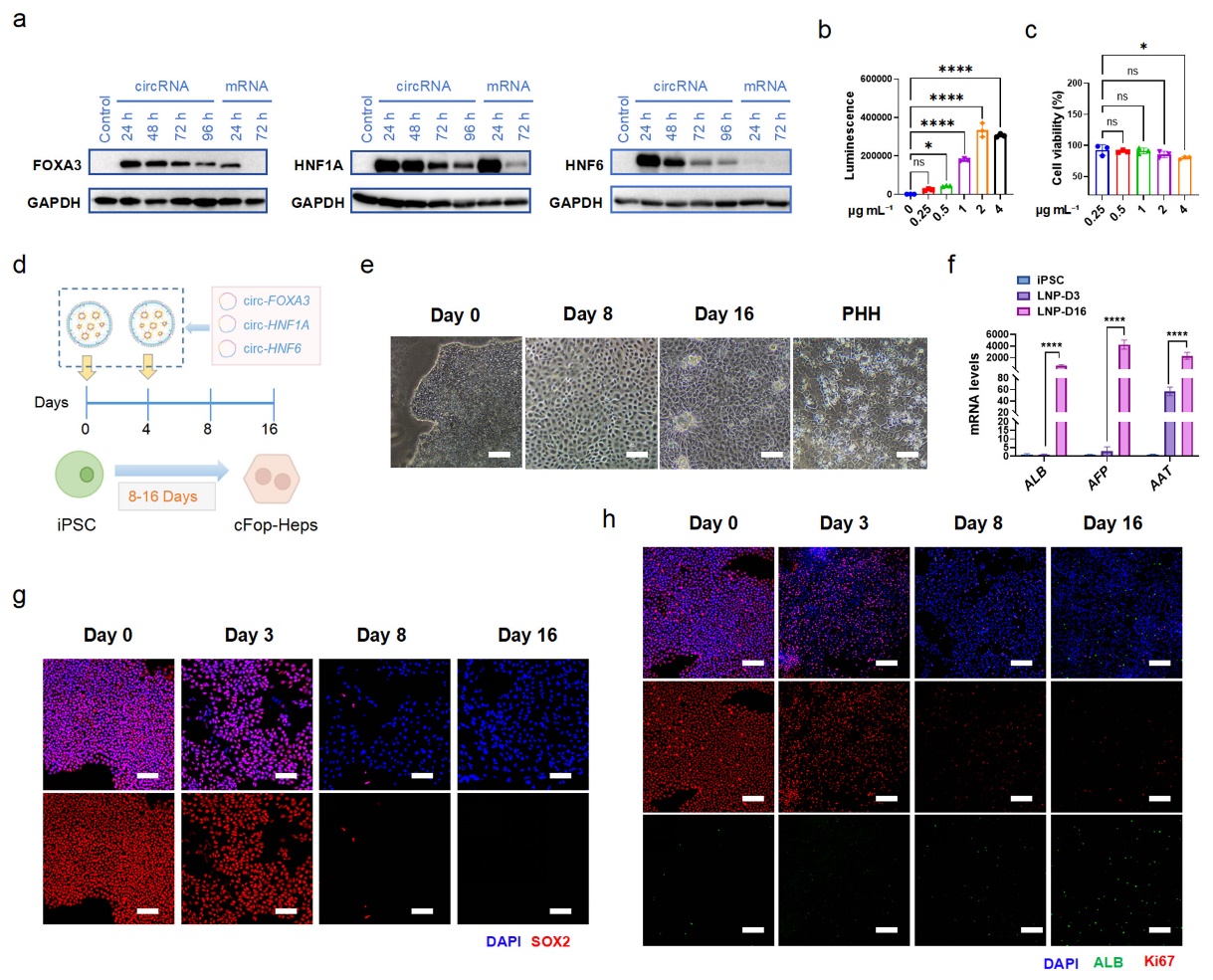
图5 circ-LEFTs介导的iPSCs向肝细胞的正向编程
通过协同递送circ-FOXA3、circ-HNF1A和circ-HNF6(circ-LEFTs),在16天内获得具有肝脏标志物以及白蛋白分泌、脂蛋白摄取和糖原储存功能的肝样细胞(图5)。
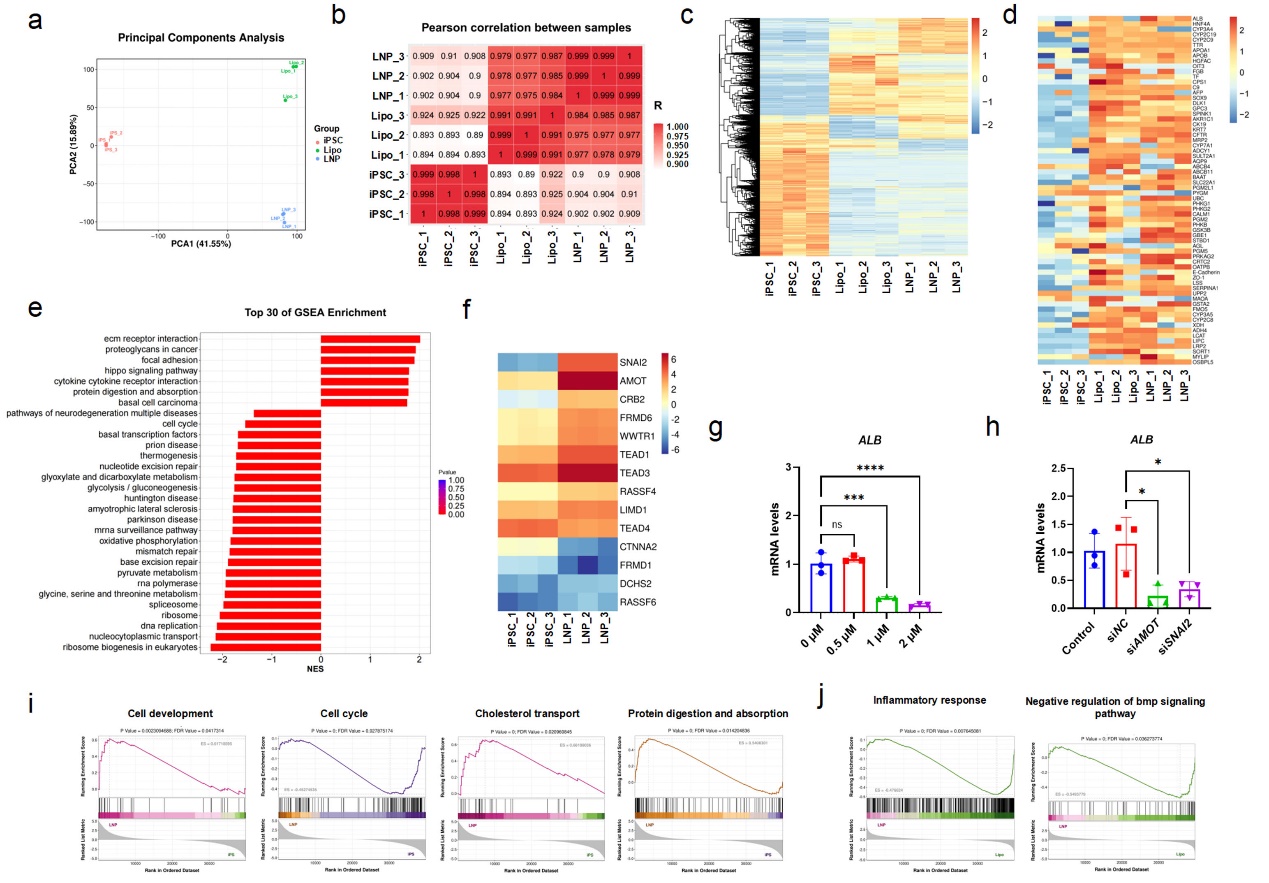
图6 转录组分析正向编程对iPSC的重塑作用
进一步的转录组分析发现,circRNA-LNP系统通过激活AMOT–Hippo–SNAI2信号轴,促进肝系定向分化。抑制该通路则显著降低肝细胞标志物表达,揭示了其在细胞命运决定中的关键作用。
该研究构建了一种非病毒、无整合、可调控的circRNA-LNP递送平台,为实现iPSC的高效、可控、规模化定向编程提供了新策略,未来在肝脏类器官模型、药物筛选和再生医学中具有广阔应用前景。研究成果以Optimized Lipid Nanoparticles Delivery Enables Efficient Circular RNA-Mediated Forward Programming and Lineage Specification of Induced Pluripotent Stem Cells 为标题发表在 Advanced Functional Materials 上。论文第一作者为苏州纳米所博士研究生吴康露,通讯作者为项目研究员王凯。研究获得了中国科学院人才计划、江苏省类器官创制与精准医疗重点实验室等支持。
附件下载:

